В литературе и исследованиях о гипнозе речь нередко заходит о возможности сознательного контроля тех или иных физиологических функций организма. Если человек сможет научиться напрямую управлять активностью отдельных регионов мозга, это может дать возможность управлять нейрофизиологическими механизмами, которые опосредуют поведение и мышление, и, возможно, создать новый путь для лечения заболеваний. В этом свете особенно важно было бы научиться управлять собственной системой модуляции болевых ощущений, что может дать реальный клинический механизм контроля над болью.
В недавних исследованиях по гипнозу это было убедительно показано. Так, по данным Rainville et al., Faymonville et al. во время гипнотических сеансов, направленных на ослабление болевых ощущений, наблюдалась повышенная нейронная активность в особом регионе мозга — передней части коры поясной извилины (anterior cingulate cortex, ACC). В серии экспериментов было доказано, что снижение уровня боли тесно коррелирует с повышением активности этой зоны мозга (я писал об этом ранее, например, в статье «Мозг и гипноз (часть1). Нейроанатомия.») Сегодня представляю вашему вниманию серию экспериментов, в ходе которых был доказано обратное: сознательное управление активностью передней поясной коры приводит к контролю над болевыми ощущениями.
Участники этого исследования проходили обучение с помощью функциональной МРТ реального времени (real-time functional MRI, rtfMRI), после чего смогли управлять нейронной активностью в клювовидной части передней поясной коры (rostral anterior cingulate cortex, rACC) — региона, который, предположительно, задействован в восприятии и регуляции боли. Когда участники намеренно вызывали уменьшение или увеличение активности rACC, они испытывали, соответственно, увеличение или уменьшение болевых ощущений. В контрольных экспериментах, когда предварительное обучение проводилось без использования rtfMRI, под контролем активности других областей мозга, а также с использованием МРТ-данных, полученных ранее от другого пациента, подобного эффекта достичь не удалось. Пациенты с хроническими болями также обучались управлять активностью rACC и сообщали о снижении уровня боли после обучения.
В исследовании использовался особый метод МР-томографии — BOLD-сканирование (англ. «blood oxygen level-dependent»), которое позволяло в реальном времени оценить потребление кислорода клетками в определённых зонах мозга.
Более подробно об исследовании
Для исследования были взяты 36 здоровых добровольцев (20 мужчин и 16 женщин от 18 до 37 лет), а также 12 пациентов с хроническими болями службы лечения боли Стэнфордского университета (8 мужчин, 4 женщины, 31-38 лет, средняя длительность болей 42 месяца). Здоровым добровольцам наносили 30-секундные болевые стимулы на область левой ладони с использованием элемента Пельтье 30х30 мм. Уровень температуры подбирали индивидуально для каждого участника перед началом сканирования (46,8 — 48,6) с помощью психометрической процедуры, которая была разработана для выявления порогового значения температуры, которую человек может терпеть не двигаясь. Всех участников пристально обследовали на предмет любых нежелательных реакций и побочных эффектов, о чём сразу сообщалось врачам Стэнфордского университета.
Методы
Участникам объяснили, что целью их тренировки было научиться управлять регионом мозга, который ответственен за обработку болевых импульсов. В пилотных экспериментах было показано, что для обучения такому навыку за короткий промежуток времени субъектам требовались стратегические инструкции. Учитывая большое количество процессов, связанных с разными зонами мозга, метод проб и ошибок, даже с использованием МРТ, был признан неэффективным. Поэтому всем участникам были в письменном виде даны следующие инструкции:
- Направлять внимание на болевой стимул и от него (к другой части тела).
- Попытаться воспринимать стимул как нейтральный сенсорный опыт или как вредный, опасный, пугающий и переполняющий.
- Попытаться ощущать интенсивность стимула как высокую или низкую.
- Постараться управлять болезненным ощущением или позволить ему управлять восприятием.
Также участникам сообщалось, что данные rtfMRI будут содержать случайный шум и отставать во времени от реальных процессов в мозгу с учётом скорости кровотока (на ~3-5 с) и компьютерной обработки (1-2 с).
Протокол тренировки участников
Вначале 8 здоровых участников прошли серию учебных сеансов в сканере, получая rtfMRI-информацию из интересующего региона в rACC в виде линейного графика (схема 1Б) и анимированного изображения в виде уменьшающегося или нарастающего виртуального пламени (схема 1В). 2D и 3D изображения мозга не использовались по причине их сложности. Каждый 13-минутный сеанс сканирования состоял из 5 циклов нарастания/затухания. В каждом тренировочном цикле присутствовал 30-секундный блок отдыха, после которого следовал 60-секундный блок нарастания, когда участникам нужно было усиливать активность в зоне rACC. После этого следовал 60-секундный блок затухания, во время чего участники должны были снижать активность в rACC. Болевой стимул наносили начиная с 10 секунды блока в течение 30 секунд. Каждый блок сопровождали текстовыми подсказками («Отдых», «Нарастание», «Затухание»). Здоровые участники проходили одно локализующее сканирование, три тренировочных сеанса и посттестовый сеанс. Посттестовый сеанс был идентичен тренировочным за исключением того, что во время посттестового сеанса участники оценивали болевой стимул сразу после его нанесения. В тренировочных сеансах стимулы оценивались только после завершения сканирования, чтобы избежать активации процессов, задействованных в самой оценке.
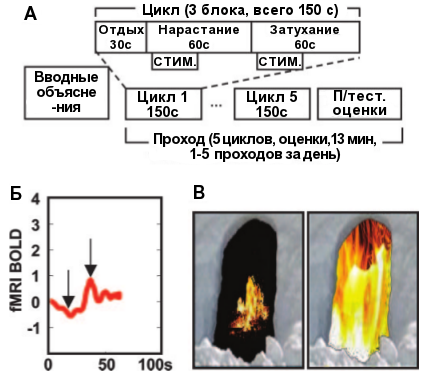
Пациенты с хроническими болями проходили подобную тренировку, но болевые стимулы им не наносили. Кроме того, по этическим соображениям они сами решали, когда завершать сканирование. Четверо прошли три полных учебных сеанса, двое завершили два сеанса, и двое прошли по одному сеансу.
Контрольные группы
Для здоровых участников были набраны контрольные группы, которые проходили схожие или идентичные процедуры в отсутствие данных МРТ. Было набрано 4 контрольные группы для здоровых участников и одна для пациентов с хроническими болями.
В первой группе (8 человек) давались аналогичные инструкции, но предполагался когнитивный контроль над болью в отсутствие данных фМРТ.
Во второй группе (8 человек) проводилась исключительно поведенческая тренировка, которая была в два раза дольше, чем в экспериментальной группе, и также в отсутствие данных фМРТ. Участникам этой группы дополнительно предлагали фокусировать внимание на тепловых стимулах во время блока нарастания и переносить фокус внимания с них на другие стимулы во время блока затухания.
В третьей группе (8 человек) проводилась точно такое же обучение, как в экспериментальной группе, но сигнал фМРТ снимали из другого участка мозга, который заведомо не был связан с обработкой болевых импульсов.
В четвёртой группе (4 человека) проводилось то же обучение, что и в экспериментальной группе, но, участникам, не уведомляя об этом, демонстрировали не их собственный фМРТ-сигнал, а записанный фМРТ-сигнал от предыдущего участника.
В контрольной группе для пациентов с хроническими болями (4 человека) использовалась вегетативная биологическая обратная связь. Участников обучали контролировать свой вегетативный тонус, наблюдая непрерывный график электропроводности кожи, частоты сердечных сокращений и дыхания и стараясь снизить возбуждение и вызвать расслабление.
Результаты
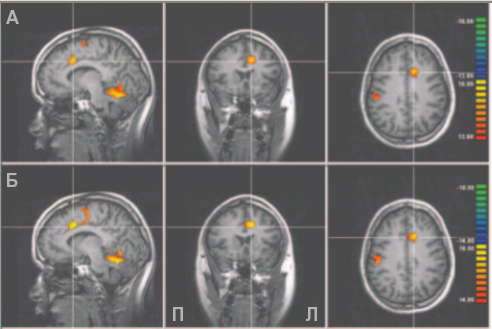
За время тренировки все участники экспериментальной группы научились контролировать сигнал фМРТ в целевой зоне. Главным показателем обучения служило нарастание разницы фМРТ-сигнала в периоды нарастания и затухания между начальным и завершающим блоками. Анализ группы после тренировки показал повышенную нейронную активность в регионе мозга, соответствующем целевой зоне rACC. В этом регионе наблюдалась наиболее интенсивная активность по сравнению с другими отделами переднего мозга (схема 2А). Также активность наблюдалась во вторичной соматосенсорной коре, островковой зоне, дополнительной моторной коре, в верхних отделах мозжечка и верхней височной извилине (похожие результаты упоминались в предыдущей статье).
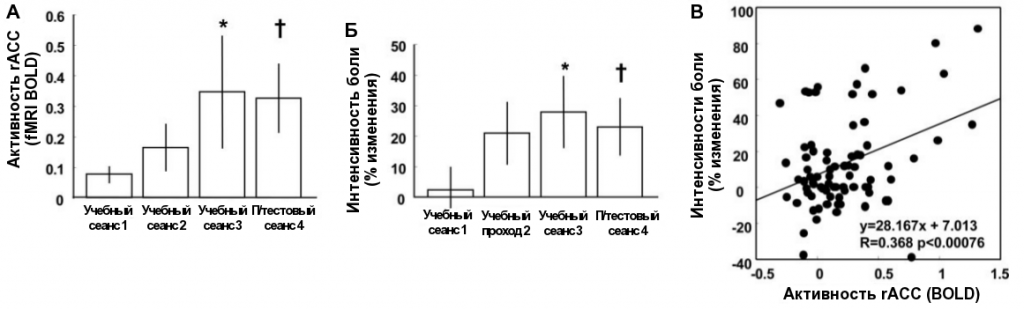
Способность контролировать активность целевой зоны посредством фМРТ нарастала в течение трёх тренировочных сеансов и сохранялась во время посттестового сеанса (схема 3А). По мере того как участники эксперимента обучались увеличивать и уменьшать активность в rACC, они сообщали о соответствующем изменении восприятия боли схема 3Б). С помощью линейного регрессионного анализа удалось установить, что между изменениями активности в rACC и уровнем болевых ощущений существует значительная корреляция (схема 3В, P<0,0007, линейная регрессия).
После тренировки участники на 23% лучше контролировали уровень интенсивности боли (сенсорный компонент) и на 38% степень её дискомфортности (аффективный компонент, схема 4). Такая динамика в экспериментальной группе была значительно более выраженной, чем в контрольных группах.
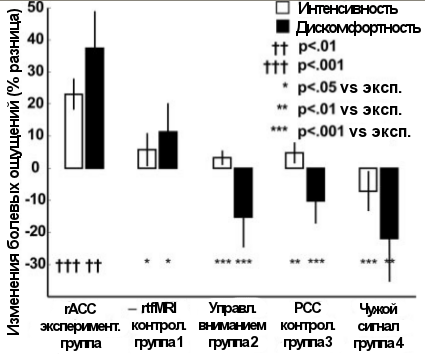
Восемь пациентов с хроническими болями после прохождения протокола с фМРТ без внешних болевых стимулов сообщили о существенном снижении среднего уровня боли, что было показано с помощью короткого опросника McGill (MPQ) и обычной визуальной аналоговой шкалы (VAS) от 1 до 10. Изменения этих параметров в контрольной группе, в которой пациенты обучались под контролем вегетативной биологической обратной связи, были в три раза ниже (схема 5А).
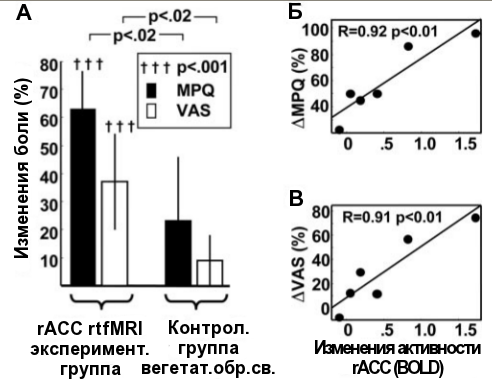
Это исследование впервые предоставило полномасштабную контролируемую демонстрацию того, что человек после определённой тренировки может научиться контролировать специфический регион мозга. Как было показано в исследованиях по гипнозу, активность нейронов передней поясной коры напрямую связана с восприятием болевых ощущений. Но в данном случае подобного контроля удалось достичь без использования каких-либо формальных гипнотических техник, используя данные из магнитно-резонансного томографа для отслеживания состояния этого региона мозга. Это открывает новые пути для изучения возможностей мозга и его функционирования.
Аналогичные исследования были проведены другими авторами, о чём я ещё буду писать в следующих статьях.
Литература:
- R. Christopher deCharms, Fumiko Maeda, Gary H. Glover, David Ludlow, John M. Pauly, Deepak Soneji, John D. E. Gabrieli, Sean C. Mackey. Control over brain activation and pain learned by using real-time functional MRI. PNAS, December 20, 2005, vol. 102, no. 51, 18626 –18631.